作者:邹振平、周英
近日,我校生物反应器工程全国重点实验室叶邦策教授团队在智能活菌药物开发及肿瘤精准治疗应用领域取得新进展。相关研究成果以“Self-adjusting Engineered Probiotic for Targeted Tumor Colonization and Local Therapeutics Delivery”为题,发表于国际一流期刊Advanced Science。
近年来,工程化细菌在肿瘤治疗领域展现出显著的应用潜力。然而,该技术仍面临如何实现对工程细菌在肿瘤组织内定植行为的时空精准调控限制。为此,研究团队成功构建了一种基于肿瘤微环境响应的自调控智能工程细菌系统。该菌株通过特异性感知肿瘤组织中特征性乳酸浓度(≥5 mM),实现了对肿瘤组织的精准靶向定植,并建立了治疗性载荷的可控释放系统。
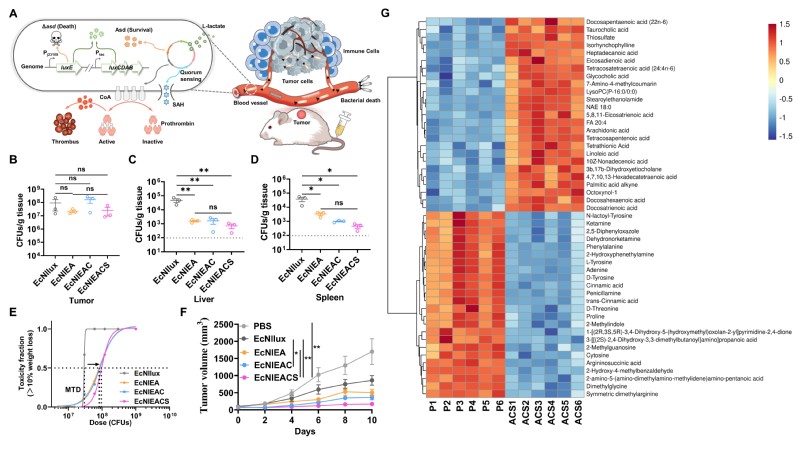
研究团队首先通过生物信息学筛选,开发了一种不受葡萄糖等肿瘤微环境抑制的新型乳酸调控元件和传感器,使工程菌能够精准响应肿瘤组织的乳酸浓度。随后耦合“感知-响应-繁殖”基因回路,使工程菌仅在肿瘤微环境中存活。工程菌组织脱靶降低2-3个数量级,最大耐受剂量提升3倍。进一步引入基于群体感应的α-溶血素自调控释放回路,以增强抗肿瘤效果。此外,由高水平乳酸诱导工程菌产生凝固酶(Coa)诱导了瘤内血栓形成。非靶向代谢组表明,血栓形成剥夺了肿瘤的营养和氧气供应,诱发肿瘤代谢重编程,协同提高了工程菌抗肿瘤效果。此外,瘤内栓塞减少了细菌和毒性蛋白泄露的风险。这种自调控的工程活菌药物肿瘤抑制率达90%,显著延长了结直肠癌荷瘤小鼠的存活时间。总之,智能化基因线路赋能的活体疗法为肿瘤的精准高效治疗提供了新的工具。
近年来,团队在合成生物学与智能活体药物开发领域取得了系列研究成果:结合生物信息学与多组学分析,挖掘了多种适配活体药物底盘的调控和功能元件并解析其信号转导机制(Nucleic Acids Research, 2025; PNAS, 2024);建立了肠道内瞬时疾病信号分子的“感知-记录-追溯”新技术(ACS Synthetic Biology, 2020, 2023; Analytical Chemistry, 2023);提出了构筑智能活体药物的基因传感线路开发和优化新策略;进一步探索了智能活体药物在炎症性肠病(Cell Host & Microbe, 2023; STAR protocols, 2023; Advanced Healthcare Materials, 2024; Analytical Chemistry, 2024),结直肠癌(Advanced Science, 2025)及高尿酸血症(Gut Microbes, 2024)等重大肠道疾病中的应用潜力。
我校博士后邹振平为论文第一作者,叶邦策教授和周英教授为通讯作者,该研究得到了国家自然科学基金重点项目,国家重点研发计划,以及博士后科学基金特别资助和面上项目的支持。
论文链接:http://doi.org/10.1002/advs.202406486