作者:邓昌平、马兴元
近日,我校生物工程学院、生物反应器工程全国重点实验室马兴元教授团队在利用肿瘤微环境响应性双特异性纳米体-PROTACs靶向癌细胞内靶点来提高治疗效果方面取得新进展,相关研究成果以“Targeting intracellular cancer proteins with tumor-microenvironment-responsive bispecific nanobody-PROTACs for enhanced therapeutic efficacy” 为题在线发表在生物医学领域知名杂志(MedComm. 2025;6:e70068)(中科院1区,IF: 10.7)上。该研究提出了一种创新的肿瘤治疗策略——基于肿瘤微环境响应的双特异性纳米抗体-PROTACs(蛋白降解靶向嵌合体)平台。这一技术通过特异性降解肿瘤细胞内的关键蛋白,显著提高了治疗效果,并降低了系统性毒副作用。
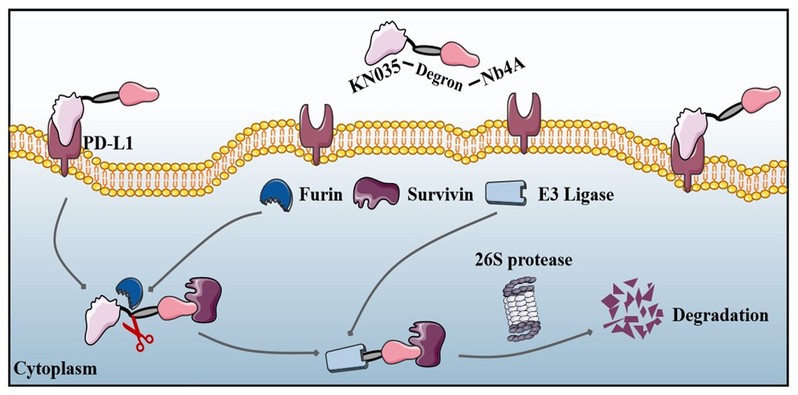
图片说明:双特异性纳米体通过肿瘤微环境响应靶向癌细胞内关键蛋白策略示意图
PROTACs是一种能够特异性降解目标蛋白的创新分子工具。与传统的小分子抑制剂相比,PROTACs可以降解细胞内的任何蛋白,包括那些难以成药的靶点。然而,传统PROTACs的非特异性分布可能导致正常组织中的蛋白降解,从而引发系统性毒性。为了解决这一问题,本研究引入了纳米抗体,并结合肿瘤微环境的特点,开发出了一种新型的双特异性纳米抗体降解平台—BumPeD。BumPeD平台的核心在于利用肿瘤微环境中高表达的Furin蛋白酶来激活蛋白降解过程。研究中设计了两种工作蛋白KVN和K14N,分别通过靶向PD-L1(细胞表面蛋白)和Survivin(细胞内蛋白)来实现对肿瘤细胞的精准打击。实验结果表明,这两种蛋白能够有效进入肿瘤细胞,并通过泛素-蛋白酶体途径降解Survivin蛋白,从而诱导肿瘤细胞凋亡,抑制肿瘤细胞的增殖和迁移。
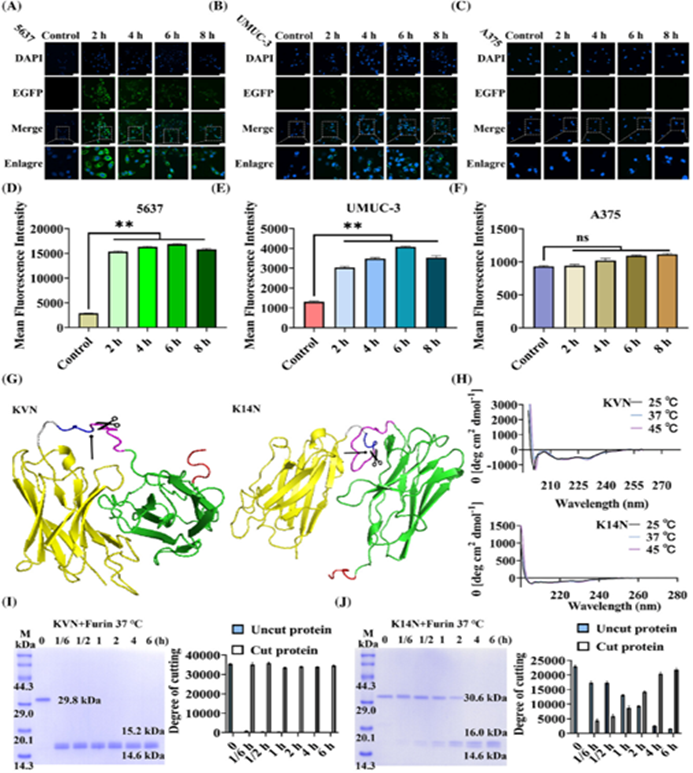
图片说明:双特异性纳米抗体降解平台—BumPeD组件及其活性表征结果图
在体外实验中,KVN和K14N蛋白在高表达PD-L1的5637和UMUC-3细胞中表现出显著的抗肿瘤活性。通过荧光显微镜和流式细胞仪检测,研究者们发现这些蛋白能够高效进入细胞,并在细胞内释放降解Survivin蛋白的活性片段。进一步的3D肿瘤球实验也证实了KVN和K14N对肿瘤生长的抑制作用。在体内实验中,研究者们利用UMUC-3细胞构建了裸鼠肿瘤模型,并通过瘤周注射KVN和K14N蛋白。结果显示,这两种蛋白能够显著抑制肿瘤生长,且对小鼠的体重和主要器官未产生明显毒性。组织学分析表明,Survivin蛋白的降解导致了Caspase-3的积累,从而促进了肿瘤细胞的凋亡,同时Ki-67蛋白的下调也表明了肿瘤增殖能力的降低。这项研究不仅提供了一种全新的肿瘤靶向蛋白降解策略,还为开发新型降解药物提供了理论基础和实验支持。BumPeD平台的灵活性和可变性使其能够根据不同的肿瘤类型和靶点进行调整,为未来的个性化癌症治疗提供了新的方向。然而,该平台也面临一些挑战,例如纳米抗体的筛选和优化,以及如何进一步提高蛋白降解效率等问题。未来的研究将致力于解决这些挑战,并探索更多基于肿瘤微环境的创新治疗策略。总之,BumPeD平台的出现为癌症治疗带来了新的希望,也为靶向蛋白降解领域的发展注入了新的活力。
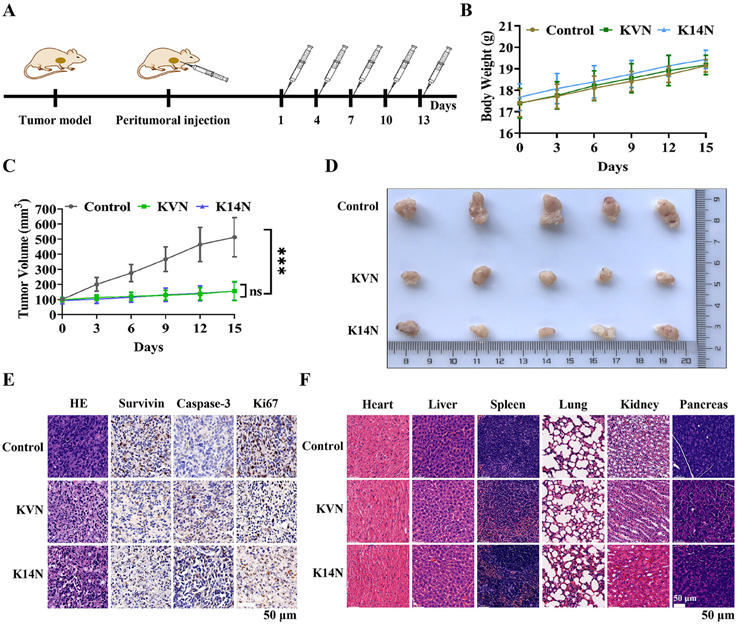
图片说明:纳米双抗KVN和K14N对肿瘤靶向抑制作用的动物体内活性评价结果图
我校为该论文的唯一通讯单位,第一作者为生物工程学院博士研究生邓昌平,通讯作者为生物工程学院、生物反应器工程全国重点实验室马兴元教授和药学院、上海市新药设计重点实验室郑文云教授。研究工作也得到了上海交通大学、香港中文大学和上海大学等合作单位研究者的帮助。本研究受国家重点研发计划“合成生物学”专项(2018YFA0902800)、国家博士后基金资助计划(GZC20231596)和国家自然科学基金(32471003)等项目的支持。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/mco2.70068