作者:杨志恒、谭高翼
10月4日,华东理工大学生物工程学院生物反应器工程国家重点实验室张立新教授和中国科学院微生物研究所王为善研究员合作在Nature旗下期刊《Nature Communications》上发表题为“A thermostable type I-B CRISPR-Cas system for orthogonal and multiplexed genetic engineering”的研究论文。这项研究开发了一种高度热稳定的Type I-B CRISPR-Cas系统,为高温菌的基因工程和转录调控提供了全新的工具。

在过去的几年里,合成生物学推动了绿色、低碳生物制造产业的高速发展,如何进一步引领下一代更有前景的“菌种—工艺—装备”一体化创制?该团队注意到嗜热微生物有潜力作为下一代工业生物技术的优势底盘,具有可开放式发酵减少灭菌成本,降低生物反应器冷却成本,减少发酵液的粘度、增加传质、加速生物转化速率等优点,在工业生产中具有巨大的潜力。然而遗传操控工具的匮乏制约了高温底盘细胞的应用。CRISPR-Cas系统已经在生命科学领域掀起了一场革命,成为了基因编辑和基因工程领域的一项关键技术。虽然CRISPR-Cas系统在常温条件下表现出色,但对于嗜热微生物的应用却一直受限。
在本研究中,该团队从热葡糖苷酶地芽孢杆菌(Parageobacillus thermoglucosidasius)中挖掘了一种高度热稳定的Type I-B CRISPR-Cas系统,该系统展示出高效的DNA切割活性,并且截短spacer长度可以实现基因编辑到转录抑制功能的切换,而不需要失活Cas3核酸酶解旋酶的功能。基于以上结果,研究团队开发了一种在P. thermoglucosidasius和E. coli中进行基因组编辑和转录抑制的正交工具。
利用这一多效工具,该团队进一步聚焦P. thermoglucosidasius低转化效率这一制约菌株工业开发的瓶颈问题,构建了基于截短spacer长度的全基因组水平的转录抑制文库。并利用此文库在全基因组水平筛选到与转化效率相关的新靶点,并通过多重抑制,建立了高效的P. thermoglucosidasius感受态细胞(~ 108 CFU/μg DNA)。此外,他们还展示了全基因组水平筛选提高核黄素产量的新靶点以及对这些靶点进行组合操作,成功构建了在高温发酵中最高产量的高温核黄素生产工厂。
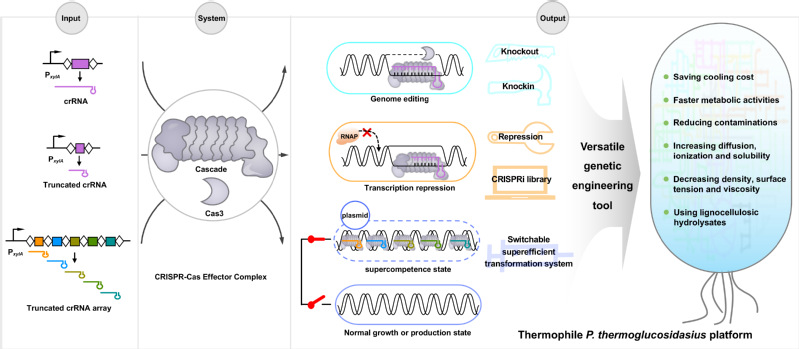
这一研究成果为在P. thermoglucosidasius中进行高效的遗传操作提供了强大的底层工具,为高温菌P. thermoglucosidasius为基础的下一代“菌种—工艺—装备”一体化生物制造奠定了基础。这一研究还得到微生物所向华研究员和李明研究员的指导。
华东理工大学生物工程学院博士研究生杨志恒,中科院微生物研究所李子龙博士和博士研究生生李碧霄为论文共同第一作者。通讯作者是中科院微生物研究所王为善研究员和我校国重室主任张立新教授,我校生物反应器工程国家重点实验室为第一单位。该工作得到了国家自然科学基金委和2023年华理双一流重点专项——智能生物制造的支持。
原文链接:https://doi.org/10.1038/s41467-023-41973-5