作者:邱勇隽
近日,我校生物反应器工程国家重点实验室及上海生物制造技术协同创新中心生物催化研究室,联合中国科学院上海有机化学研究所和上海交通大学等单位人员协同攻关,将具有部分对映归一性的天然绿豆环氧水解酶进行理性设计和基因重编程,创制成功一个巧夺天工的魔力新酶,在催化苯乙烯环氧化物的水解反应中,实现了近乎完美的对映体汇聚效应,使左旋和右旋的环氧底物几乎全部转化为手性药物合成所需的(R)-二醇。该成果近期发表在美国化学会催化旗舰刊物ACS Catalysis上,题为“Regioselectivity Engineering of Epoxide Hydrolase: Near-PerfectEnantioconvergence through a Single Site Mutation”(ACS Catal.2018, 8, 8314−8317, DOI: 10.1021/acscatal.8b02622).
光学纯的邻位二醇是一类重要的手性药物合成砌块,例如以苯乙烯氧化物衍生得到的手性邻位二醇可以合成单一对映体的β-肾上腺素阻断剂,在治疗高血压、心律失常等心脑血管疾病中具有很好的疗效。早在十多年前(Org. Lett. 2006),我校研究人员率先从绿豆粉中发现两个独特的环氧水解酶VrEH1和VrEH2,它们在催化对硝基苯乙烯类氧化物的水解过程中发生了有趣的对映体汇聚现象,其产物(R)-二醇的得率突破了传统拆分反应最高50%的理论极限。但是,由于天然酶的立体选择性不够完善,造成环氧对映体汇聚反应的效果不甚理想,没有达到理论收率100%的完美境界。
现在,这一困扰酶工程学界多年的挑战课题近期在我校取得重要突破。首先,我校范立强副教授对上述绿豆来源的绿豆环氧水解酶成功进行了克隆和表达,为进一步改造奠定了遗传学基础(Appl MicrobiolBiotechnol 2014;Catal. Commun. 2015)。其次,我校孔旭东博士在上海有机化学研究所周佳海研究员的指导下成功解析获了环氧水解酶VrEH2的晶体结构;接着李付龙同学经过优化获得了高分辨的酶分子(PDB:5XM6)及其与底物复合物的结构(PDB:5YB5),并借助于计算机模拟准确锁定了酶分子中控制底物结合构象的关键氨基酸位点。在构建突变体库时,通过设计精简的四氨基酸字母表(V-F-W-N)对候选氨基酸进行定点突变,建立了一个小巧型突变体酶库,极大地减少了库容量,显著提高了酶分子改造的针对性和有效性。最终,成功靶向到调控酶催化不同对映体区域选择性反应的关键位点(Met263),而且发现该位点的调控作用具有一定程度的普适性,这为同源环氧水解酶的区域选择性改造提供了新思路和新方向。
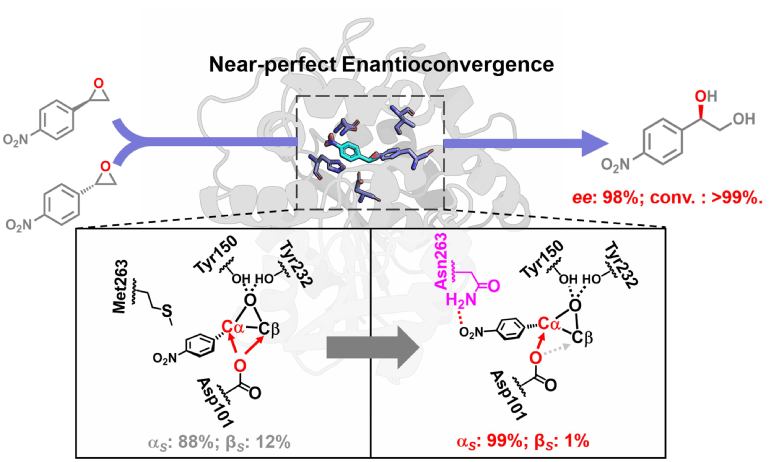
图片说明:绿豆环氧水解酶经过区域选择性改造后实现近乎完美的对映汇聚
上述研究受到国家自然科学基金重点项目和上海市合成生物学重点项目的资助。该工作主要由华东理工大学在学博士生李付龙同学在导师许建和、郁惠蕾教授的共同指导下完成,其中部分结构解析工作由华理博士生孔旭东同学在中国科学院有机化学研究所周佳海研究员的共同指导下完成,同时得到了中国科学院林国强院士、上海交通大学徐沁副教授以及华东理工大学范立强副教授和陈琦博士的悉心指导和鼎力支持。
原文链接: https://pubs.acs.org/doi/10.1021/acscatal.8b02622